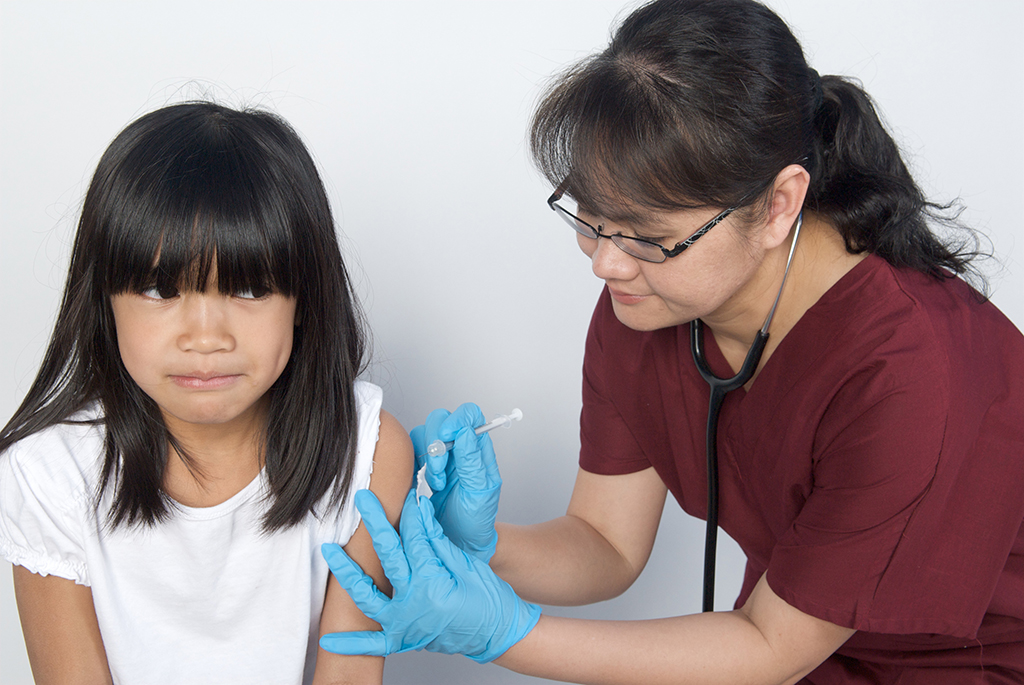
La FDA abre una revisión de seguridad de los medicamentos inyectables contra el VSR
Funcionarios de la Administración de Alimentos y Medicamentos (FDA) abrieron una revisión de seguridad de dos medicamentos inyectables utilizados para proteger a bebés y niños pequeños del VSR , el virus respiratorio que envía a miles de niños estadounidenses al hospital cada año.
Los medicamentos de acción prolongada de Merck y Sanofi no son vacunas, pero la revisión del gobierno llega mientras los funcionarios de salud y los asesores del Secretario de Salud Robert F. Kennedy Jr. retiran las recomendaciones sobre las vacunaciones infantiles de rutina.
Un portavoz de Kennedy describió la investigación como una evaluación de seguridad de rutina y dijo que la FDA «actualizará el etiquetado del producto si la totalidad de la evidencia lo justifica».
Las dos compañías farmacéuticas dijeron en declaraciones separadas que no han visto nuevas señales de seguridad con sus medicamentos, que fueron aprobados en los últimos años para bebés y niños pequeños que enfrentan el VSR.
La noticia de la revisión fue reportada primero por Reuters.
Los medicamentos son esencialmente versiones de laboratorio de anticuerpos naturales que ayudan al sistema inmunitario a combatir el VSR. La FDA ha aprobado vacunas para pacientes mayores y mujeres embarazadas , pero no para bebés ni niños, lo que convierte a las inyecciones en un tratamiento de primera línea para los jóvenes contra el virus estacional.
Un portavoz de Merck, fabricante de Enflonsia, dijo que representantes de la compañía se reunieron con la FDA la semana pasada.
“Esperamos preguntas de la FDA y queremos que las haga”, declaró la compañía. “Creemos profundamente en la importancia de la transparencia y valoramos la rigurosa revisión que realiza la FDA de los datos clínicos de todos nuestros productos”.
La inyección de Merck está aprobada para proteger a los bebés antes o durante su primera temporada de VSR, que generalmente dura cinco meses.
Un portavoz de Sanofi dijo que la empresa envía periódicamente cualquier posible preocupación en materia de seguridad a la FDA para su revisión, pero que no ha detectado ninguna señal nueva con su medicamento en más de 50 estudios.
“En este momento, no se ha identificado ningún problema de seguridad en los estudios clínicos de (Beyfortus) ni en la experiencia posterior a su comercialización con más de 6 millones de bebés inmunizados en todo el mundo”, afirmó la compañía en un comunicado.
Una infección por VRS es una molestia similar a un resfriado para la mayoría de las personas sanas, pero puede ser potencialmente mortal para los muy jóvenes y los ancianos.
En 2023, los asesores de los Centros para el Control y la Prevención de Enfermedades recomendaron la administración de vacunas de anticuerpos a los bebés nacidos justo antes o durante la temporada del VRS, siempre que la madre biológica no se vacunara en las últimas etapas del embarazo. El panel también recomendó una dosis para algunos niños de 8 a 19 meses con mayor riesgo de contraer una enfermedad grave por el VRS.
Desde que asumió el Departamento de Salud y Servicios Humanos, Kennedy reemplazó a todos los miembros del comité de los CDC, que también hace recomendaciones sobre vacunas.
La semana pasada, el panel instó a suspender la vacunación sistemática de recién nacidos contra la hepatitis B , un virus que puede causar insuficiencia hepática o cáncer de hígado. La decisión provocó una rápida reacción negativa de numerosas sociedades profesionales médicas y científicas.
Por otra parte, los funcionarios de la FDA han estado examinando la seguridad de las vacunas, en particular las vacunas contra la COVID-19, y han propuesto planes para una revisión total del enfoque que la agencia ha aplicado durante décadas para aprobar y revisar las vacunas.